- 2025-11-21 16:23:40· 常见问题解答:TOC传感器和TOC分析仪有何区别?
- 2025-03-05 20:54:20· Sievers Boron Ultra在线超纯水硼分析仪
- 2025-03-05 20:54:33· Sievers Boron Ultra超纯水硼分析仪:新功能
- 2023-04-14 14:20:14· Sievers* M500 总有机碳TOC分析仪 准确 高效 可靠
- 2023-04-14 14:15:39· Sievers* M9 总有机碳TOC分析仪 确保合规的同时,实现高效工作
- 2023-04-14 14:07:24· Sievers* InnovOx 在线型总有机碳TOC分析仪用于有机物监测包
- 2023-04-14 14:03:17· Sievers* Eclipse月食 合规、一致、清晰的细菌内毒素检测仪
- 2023-04-14 11:08:44· DataShare Elite 软件
- 2023-04-03 10:35:36· 工业过程监测痛点要避免的5个TOC分析问题
- 2022-10-10 16:02:54· 总有机碳TOC监测使制糖厂结束度量缺漏,将营收损失降至最低
- 2022-05-11 12:37:55· 与HPLC相比,用TOC分析进行清洁验证的优势
- 2022-01-19 14:12:13· Sievers M9 SEC溶解有机碳检测器
- 2022-01-19 14:12:13· Sievers认证的标准品及消耗品手册
- 2022-01-19 14:12:13· Sievers 500 RLe在线总有机碳TOC分析仪产品样册
- 2022-01-19 14:12:13· Sievers 860实验室型总有机碳分析仪与自动进样器RT12产品样册
- 2022-01-19 14:12:13· Sievers InnovOx ES实验室型总有机碳TOC分析仪产品样本
- 2022-01-19 14:12:01· Sievers超纯水在线硼分析仪Boron
- 2022-01-19 14:12:01· Sievers 500RL在线型总有机碳TOC分析仪
- 2025-12-15 16:51:02· 300 40074 CS Rev. A - Eclipse使用重组级联试剂分析细菌内毒素
- 2025-03-05 20:53:13· 用在线硼分析技术来优化离子交换工艺监测
- 2023-08-23 11:27:51· 制药行业系统适用性测试—苯醌与蔗糖的TOC测定
- 2023-08-23 11:27:51· 在线监测还是离线吸样检测?
- 2023-08-23 11:27:34· SIEVERS*M系列TOC分析仪TURBO运行模式的响应时间可实现快速泄漏检测
- 2023-08-23 11:27:34· 用SIEVERS* INNOVOX TOC分析仪测定氢氧化钠(NAOH)中的总无机碳(TIC)
- 2023-08-23 11:27:34· 分析STERIS清洁剂中的非导电性有机化合物的TOC与电导率
- 2023-08-23 11:27:34· 使用SIEVERS M9分析仪检测清洁验证样品0.2M KOH中的TOC
- 2023-08-23 11:27:34· 使用SIEVERS M9分析仪检测清洁验证样品0.2M NAOH中的TOC
- 2023-08-23 11:27:34· TOC清洁验证棉签套装比较
- 2023-08-23 11:27:34· TOC方法回收复杂化合物:清洁剂
- 2023-08-23 11:27:34· 低总有机碳(TOC)测定的试管准备准则
- 2023-08-23 11:27:34· 根据总有机碳、无机碳和电导率数 据实时放行设备的在线清洁验证
- 2023-08-23 11:27:34· 低水溶性化合物TOC分析—清洁验证中棉签回收率的评估
- 2023-08-23 11:27:20· 蛋白质样品清洁验证中TOC分析仪的比较——燃烧-NDIR方法与UV/过硫酸盐-膜电导方法的比较
- 2023-08-23 11:27:20· 与HPLC相比,用TOC分析进行清洁验证的优势
- 2023-08-23 11:27:20· 揭密清洁验证中的最大残留限值(MCL)计算
- 2023-08-23 11:27:20· 验证在制药行业中采用TOC方法进行清洁验证的方法
- 2026-02-27 11:49:30· 回顾总有机碳TOC和电导率的基础知识
- 2026-02-06 14:28:11· 重组细菌内毒素试剂的验证
- 2026-01-30 12:28:06· 用Sievers InnovOx ES实验室型TOC分析仪分析硫酸中的总有机碳
- 2026-01-22 15:28:37· 清洁验证支持包——助您轻松完成清洁验证规程
- 2026-01-14 13:57:53· Sievers Soleil快速微生物检测仪特点
- 2026-01-14 13:57:53· Sievers M500e在线TOC分析仪特点
- 2026-01-14 13:57:53· Sievers M500在线TOC分析仪特点
- 2026-01-14 13:57:53· 通过监测总有机碳TOC和优化工艺来降低饮用水厂的运营成本
- 2025-12-18 17:16:03· 如何优化EDI功率设置以提高超纯水(UPW)质量?
- 2025-11-28 11:20:12· 用Sievers InnovOx ES实验室型TOC分析仪分析6N硝酸中的有机物
- 2025-10-23 16:02:09· 低水溶性化合物TOC分析:清洁验证中棉签回收率的评估
- 2025-09-26 11:08:10· Sievers M9分析仪电导率检测稳固性的改进和最佳操作
- 2025-09-20 09:48:11· 乙烯废水工艺控制中成功关联BOD和TOC
- 2025-09-12 10:21:27· 旁线(At-line)TOC为制药商减少92%的清洁验证成本和产品转换成本
- 2025-09-05 11:12:55· 细菌内毒素检测的革命性进展——微流控技术和重组试剂引领潮流
- 2025-08-29 14:12:36· 总有机碳TOC监测用于控制凝结水回水
- 2025-08-29 14:12:36· Sievers Eclipse细菌内毒素检测:克服抑制/增强干扰的操作程序
- 2025-08-29 14:12:36· 超纯水硼分析仪在优化EDI功率设置和性能时的应用
- 2026-02-13 11:11:40· Sievers TOC分析仪长假前后使用小贴士
- 2025-12-15 16:50:41· 用户实例:从凝胶法转至光度法检测细菌内毒素——Eclipse细菌内毒素检测仪
- 2025-12-15 16:50:41· 与HPLC相比,用TOC分析进行清洁验证的优势
- 2025-11-14 13:06:30· 快速高效精确 | 你要的TOC分析仪都在这里:Sievers TOC分析仪选型指南
- 2025-11-06 12:20:18· 计算清洁验证的最大允许残留量(MAC)
- 2025-10-31 16:07:19· 浓缩氯化钠溶液的高灵敏度TOC分析
- 2025-10-17 11:00:09· 鲎试剂与新型重组级联试剂(rCR)对细菌内毒素检测结果的比较研究
- 2025-10-11 15:06:24· Sievers分析仪与您相约CIPM药机展,青岛见!
- 2025-08-21 13:23:25· 向实时检测转移的过程中保持数据可靠性
- 2025-08-21 13:23:25· Sievers Eclipse细菌内毒素检测:克服抑制/增强干扰的操作程序
- 2025-08-21 13:23:25· 宠粉时刻 | 2025年7月微信活动获奖名单
- 2025-08-21 13:23:25· 有奖快问快答——制药行业总有机碳TOC的监测效率
- 2025-07-24 14:17:40· 快问快答——制药行业总有机碳TOC的监测效率
- 2025-07-17 15:24:10· 如何理解经认证的标准品的不确定度
- 2025-07-10 18:03:19· 制药行业系统适用性测试—苯醌与蔗糖的 TOC测定
- 2025-07-03 16:08:37· 化肥生产过程和产品的总有机碳TOC含量评估
- 2025-06-26 15:49:49· 清洁验证白皮书:使用TOC方法进行清洁验证
- 2025-06-13 11:00:28· 2025版《中国药典》变化:制药用水检测“减负”,电导率可替代多项检测
细菌内毒素检测的方法变更

制药行业QC部门经常寻求新的创新产品来简化检测。他们需要合规且可靠的分析仪器,便于分析人员使用并减少在实验室中的占用空间。通常而言,公司希望变更或升级到新的技术,但同时他们又可能因必须进行的变更而感到不情愿。
细菌内毒素测试(BET,Bacterial Endotoxins Test)是一个关键的放行检测,每个QC实验室必须在放行产品之前进行内毒素检测,但目前使用的大多数方法和仪器都已过时且繁琐。当实验室想要改变方法或升级到新的BET技术时,他们需要评估和完成几个步骤,有了Sievers® Eclipse®月食细菌内毒素检测仪,这个过程就很简单了。

每家制药公司的内部程序都不同,因此也需要将个别准则纳入变更。好消息是,在内毒素检测方面,整个行业的变化过程应该是相似的。
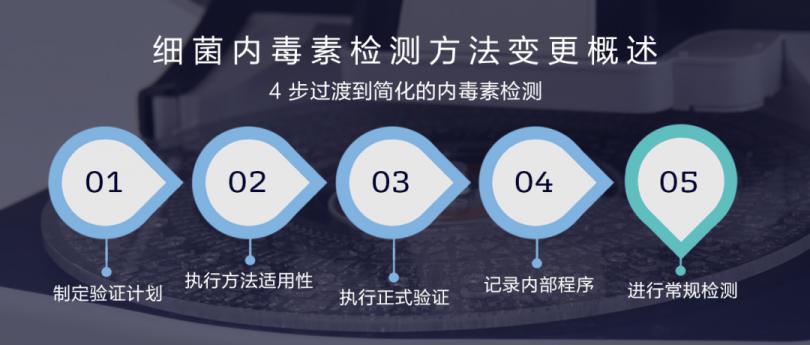
当QC实验室想改变内毒素检测方法时
有四个简单步骤可以遵循
01、制定验证计划
首先,实验室应确定他们希望使用新方法或产品检测的样品和产品类型(如,水、原料、中间体和/或最 终药物产品)。确定产品后,实验室应列出每种类型样品进行再验证的要求。例如,如果实验室希望对药品从96孔板方法转变为使用Sievers Eclipse进行检测,需要重新验证,他们应该在几个稀释度上对该产品进行筛选,直到最 大有效稀释度(MVD),以确保回收率是可以接受的。一旦确定大致情况并知道了样品类型,就可以申请获取这些特定样品以进行重新验证测试。
02、执行方法适用性
当需要对产品执行方法适用性时,确认内毒素限值和MVD以确保进行正确的稀释非常重要。一旦知道了这些,就可以开始抑 制/增强筛选,确定最 佳的非干扰稀释度,以实现最 好的回收率,理想情况下在75-125%之间。这些结果应记录在案并进行复核。
03、执行正式验证
一旦确定某一产品的稀释度,实验室应使用该理想稀释度对每种产品的三个离散批次进行检测,然后记录、复核和签发结果。
04、记录内部程序
当产品完成三个批次的验证阶段,实验室应使用新方法/技术创建验证报告。完成并签发分析报告后,可以根据标准操作规程(SOP)实施变更控制,以成功地将产品检测变更为新方法。变更控制完成后,实验室可以在内部更新内毒素检测SOP和程序,将新方法用于其产品。

一旦完成这四个步骤,QC实验室就可以开始对已使用新方法/技术重新验证的产品进行常规检测。有了一个完善的产品和样品再验证计划,这个过程就不再那么困难。当然,内部程序的变更会因公司而异,但总体来说,更改内毒素检测方法是一个简单的过程。
-
推荐产品资讯
-
联系我们


在线留言